
自身免疫性疾病中,有一些抗体专门瞄准神经元的抗原,会让患者出现各种各样的神经问题,如癫痫、精神病、痴呆等等。早期研究虽然发现这些自身抗体能引发疾病,但想要深入了解它们的致病机制、有哪些特性、和靶标怎么相互作用,却困难重重。近年来,患者来源的单克隆自身抗体开发技术的发展,为科学家提供了新平台,可以在体内外模型中对免疫生物学及自身抗体致病性展开细致研究。本文聚焦于神经自免单抗的最新进展,并探讨其在疾病机制研究和科学工具、免疫疗法开发等方面的潜力。
一、自身抗体与自身免疫性脑炎
针对一些专门攻击神经元和神经胶质细胞上的蛋白质的研究,让人们认识了“自身免疫性脑炎(AEs)”这一种新的神经疾病。随着新型抗神经元自身抗体的不断发现(如抗水通道蛋白4(AQP4)抗体、抗N-甲基-D-天冬氨酸受体(NMDAR)抗体、抗富亮氨酸胶质瘤灭活蛋白1(LGI1)抗体等),AEs的研究领域迅速扩展。这些抗体通过和神经元表面抗原的胞外区结合,例如一些离子通道或者重要的突触蛋白,就能改变电生理功能和突触传递过程。从前由于样本稀缺,人自身多抗成分复杂等原因,限制了神经自身抗体的功能研究进展。随着人单抗开发技术的发展,这一困境很大程度被改善。现在的技术可以获得疾病特异性抗体,帮助研究人员解析体液免疫反应抗体库,加深对抗体功能的认识。
二、从患者样本中获得单克隆自身抗体
一种常用的方法是单细胞技术,利用荧光激活细胞分选(FACS)技术从患者血液或者脑脊液样本中分离单个记忆B细胞(MBCs)和抗体分泌细胞(ASCs),随后测序获得抗体序列,重组表达验证抗原结合活性(图1)。另一种方法是杂交瘤技术,它通过将人原代B细胞与骨髓瘤细胞融合,生成可无限增殖的杂交瘤细胞。但让细胞系稳定并不容易,而且合适的融合伴侣也不好找。还有结合微流控系统和单细胞测序的方法,可高通量分析B细胞多样性和抗体库,但无法确定抗体效应功能和抗原特异性。
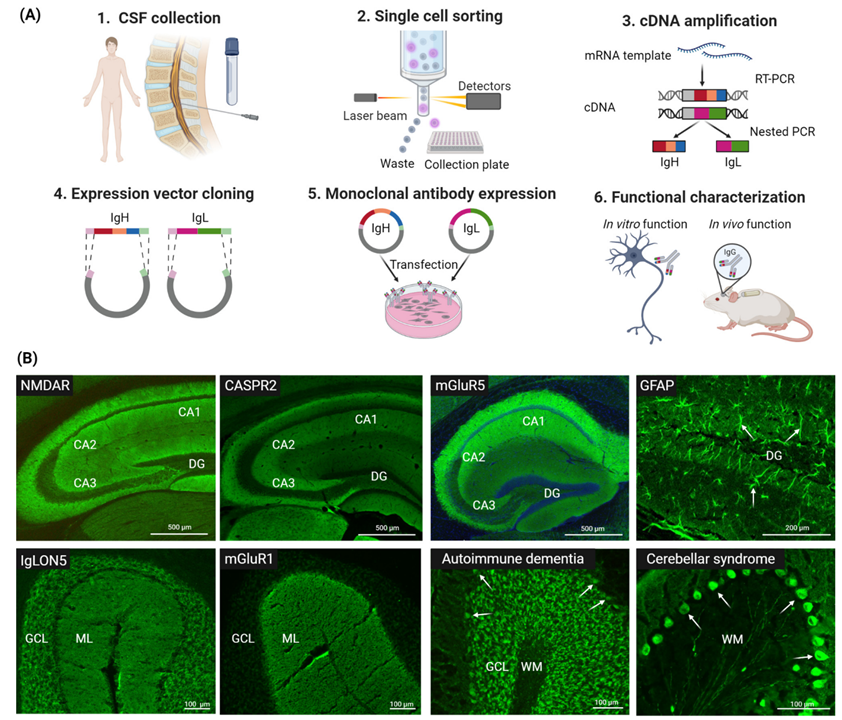
图1患者来源单克隆自身抗体的获得及验证
三、利用人类抗神经元单克隆抗体解析疾病机制
1、补体依赖细胞毒性(CDC)与抗体依赖细胞毒性(ADCC)
CDC和ADCC在疾病发生过程中起着重要作用。就拿AQP4抗体来说,它和星形胶质细胞表面的AQP4结合以后,会激活补体成分C1q,进而形成膜攻击复合物(MAC)产生CDC效应裂解细胞;同时,自然杀伤细胞(NK细胞)通过识别AQP4抗体Fc段介导ADCC(图2 A B)。这两个过程在视神经脊髓炎谱系病(NMOSD)的病理过程中都十分关键。科学家通过动物实验证实,人AQP4单抗可以复现出和疾病一样的组织病理损伤,验证了这两种机制的核心作用。
2、受体交联与内化
有些抗体能让受体交联然后内化。例如NMDAR抗体在神经元表面能把NMDAR交联起来,导致受体被细胞吞入并降解,从而减少突触表面受体密度并抑制电流传导,最终引发患者记忆缺陷和易发癫痫(图2 C)。在小鼠脑室内注射NMDAR单抗可模拟NMDAR脑炎的关键病理特征。其他一些受体的抗体可能也有类似机制,但有待进一步研究证实。
3、蛋白-蛋白相互作用干扰
还有些抗体会干扰蛋白-蛋白相互作用(PPI)。例如LGI1抗体分为靶向EPTP结构域,和LRR结构域的两类。前者阻止LGI1与突触前/后受体去整合素金属蛋白酶(ADAM)23/22的结合,后者导致ADAM22/23-LGI1复合物被细胞内化,共同破坏突触复合物形成,导致神经元过度兴奋和癫痫发作(图2 D)。给小鼠海马注射这两种抗体,能够复现疾病的关键特征。
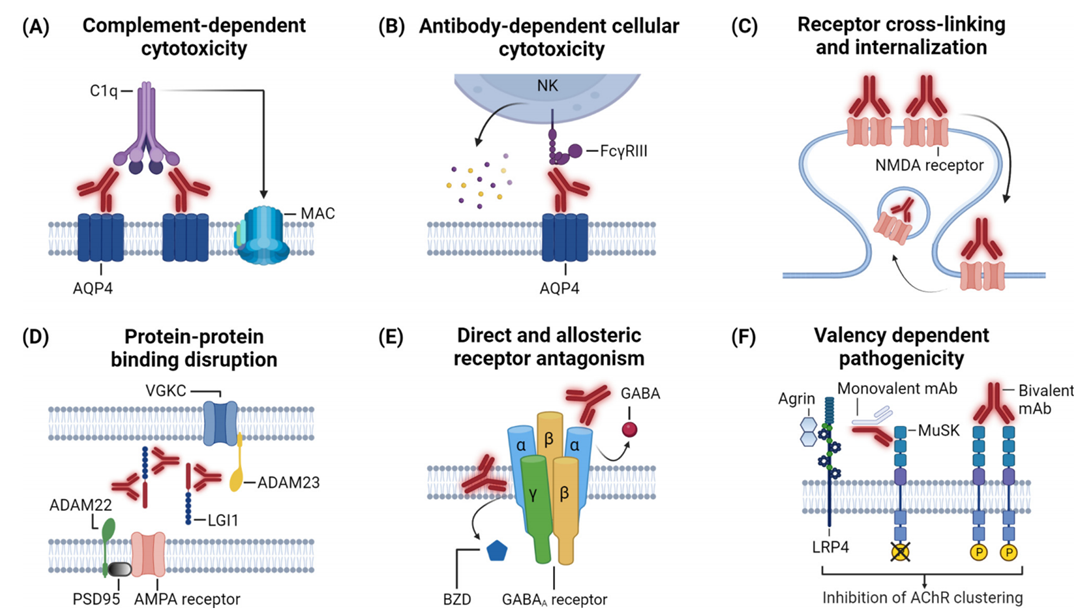
图 2. 利用人类抗神经元单克隆自身抗体发现的疾病机制
4、受体竞争性与变构抑制
另一些抗体能改变受体功能。例如GABAₐR抗体通过直接结合受体亚基,降低GABA抑制性突触传递的抑制信号,引发难治性癫痫(图2 E)。向小鼠鞘内注射抗体或其Fab片段可诱导自发癫痫,且该效应与受体无关,说明是抗体直接抑制了受体从而发挥作用。
5、抗体价态依赖性效应
有些抗体可发挥价态依赖的不同效应。例如重症肌无力(MG)相关的肌肉特异性激酶(MuSK)抗体价态不同能发挥相反的作用:二价抗体交联MuSK受体,促进其磷酸化;而单价抗体抑制MuSK与聚集蛋白agrin-LRP4复合物结合,抑制磷酸化(图2 F)。虽然两者最终均导致乙酰胆碱受体聚集减少,但涉及的机制相当复杂,也体现出在单克隆水平分析自身抗体的重要性。
四、抗神经元单克隆抗体作为新型科学工具的应用
1、自身抗体亲和力
通过表面离子共振(SPR)分析患者来源单抗的亲和力与动力学,可以帮助解释为什么患者自身抗体滴度相近,但临床症状差异巨大(图3 A)。例如AQP4阳性NMOSD或NMDAR脑炎患者,自身抗体水平与疾病严重程度仅呈弱相关,提示评估其他抗体特性的重要性。
2、 结构生物学与表位分析
靶标表位是自身抗体致病性的一个决定特征。例如LGI1自身抗体至少包含两组表位特异性和功能效应不同的单克隆抗体(图 3B)通过X射线晶体学分析和冷冻电镜能把抗原的三维结构解析出来,揭示抗体-抗原相互作用的原子水平细节。例如,冷冻电镜显示GABAₐR抗体通过不同界面和作用模式干扰受体功能,为精准治疗提供结构基础(图3 C)。
3、超高分辨率显微镜成像
直接随机光学重建显微镜(dSTORM)等技术可以在纳米尺度下观察神经元突触组织,看抗体对受体定位的影响。如dSTORM显示NMDAR抗体导致突触后NMDAR在纳米尺度下重分布,为理解突触功能障碍提供直观证据(图3 D)。
4、抗原靶标鉴定与诊断标准化
单抗还可帮助鉴定抗原靶标。通过像免疫沉淀-质谱(IP-MS)技术,可以发现未知抗原如接触蛋白相关蛋白-2(CASPR2)(图3 E)。此外,单克隆抗体作为标准参考品,帮助建立定量免疫测定方法,让不同实验室检测抗体滴度的结果更可比、更可靠。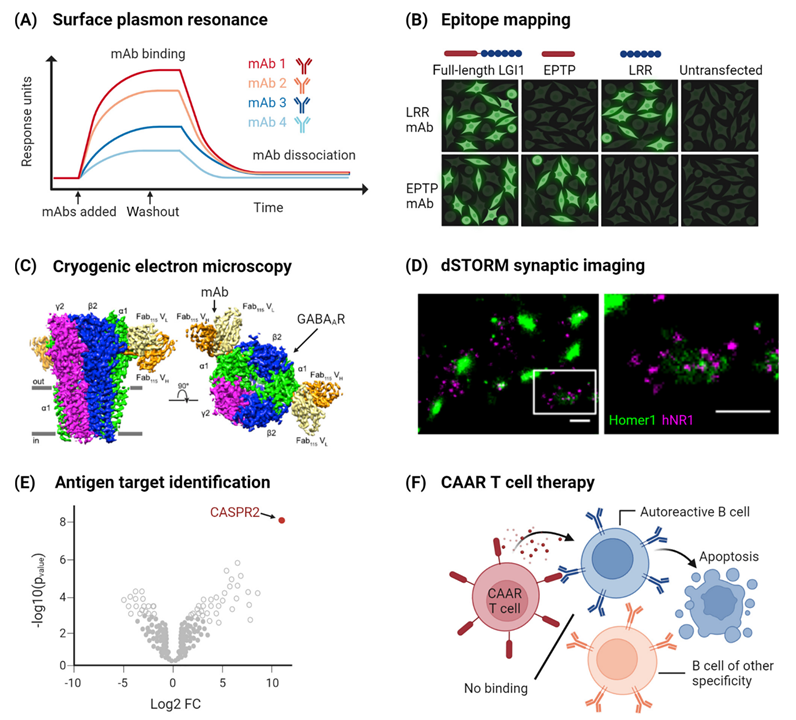
图 3.单克隆自身抗体作为新型科学工具
五、抗体选择性免疫疗法的开发
以前治疗AEs的方法,例如激素、免疫吸附、B细胞耗竭剂等非针对性疗法,容易带来严重的副作用。现在有了单克隆抗体技术,就可以开发更精准的治疗方法。例如aquaporumab,它能够阻断AQP4,但不会激活补体,从而避免细胞毒性。还有Seldegs技术,它把抗原和Fc片段融合在一起,从而捕获致病自身抗体然后把它们降解掉。此外,嵌合自身抗体受体(CAAR)T细胞疗法也很有前景,这种工程化的T细胞能表达致病性自身抗体的靶抗原,它能识别并清除那些产生自身抗体的B细胞。
六、结论与展望
患者来源的单克隆自身抗体不仅为解析AEs致病机制提供了关键工具,还推动了诊断标准化和精准治疗的发展。未来研究需解决的问题包括:新型自身抗体的靶标鉴定、脑脊液抗体组学分析、神经保护性自身抗体的发现,以及高通量单细胞技术的普及等。随着技术进步,单克隆抗体将在神经免疫疾病的机制研究和治疗创新中发挥更核心的作用,有望实现AEs的个体化治疗和治愈的目标。
关注点:
(1) 在单克隆水平对神经元自免抗体展开研究,将极大促进对疾病机制的认知、科学工具和新型免疫疗法的开发,但这需要更有力的单抗开发技术。
(2) 文中提及的抗体开发技术均是从B细胞出发,Rapid Novor快序生物全球唯一的血清多抗测序技术,可以直接对人血清多抗蛋白测序,获得天然抗体序列,助力自免疾病研究[2]。
参考文献:
[1] Duong SL, Prüss H. Molecular disease mechanisms of human antineuronal monoclonal autoantibodies. Trends Mol Med. 2023;29(1):20-34.
[2] Le Bihan T, Nunez de Villavicencio Diaz T, Reitzel C, Lange V, Park M, Beadle E, Wu L, Jovic M, Dubois RM, Couzens AL, Duan J, Han X, Liu Q, Ma B. De novo protein sequencing of antibodies for identification of neutralizing antibodies in human plasma post SARS-CoV-2 vaccination. Nat Commun. 2024 Oct 10;15(1):8790.