在人体的免疫系统中,免疫球蛋白(Ig)意义重大。它既可以作为B细胞受体(BCR)存在于B细胞表面,也能在分泌后成为抗体,帮助人体识别并抵御抗原威胁。据估计人体内抗体序列超过1013种,因此深入探究BCR库和分泌型抗体库的技术对于理解人类适应性免疫至关重要。本文中,作者对高通量B细胞受体测序(BCR-seq)和基于质谱的抗体肽测序(Ab-seq)技术在全面解析体液免疫的应用进行了比对整合研究。

研究方法
目前,BCR-seq主要有批量(bulkBCR-seq)和单细胞(scBCR-seq)测序两种方法。bulkBCR-seq能提供高采样深度,可更好地覆盖BCR库的多样性;scBCR-seq虽采样深度较低,但能获得重链和轻链的天然配对。然而,BCR-seq无法直接用于分析分泌型抗体,而Ab-seq则可通过质谱技术从血清中分析抗体组成,二者结合有望全面揭示适应性免疫库的基因组和蛋白质组层面信息(图1)。
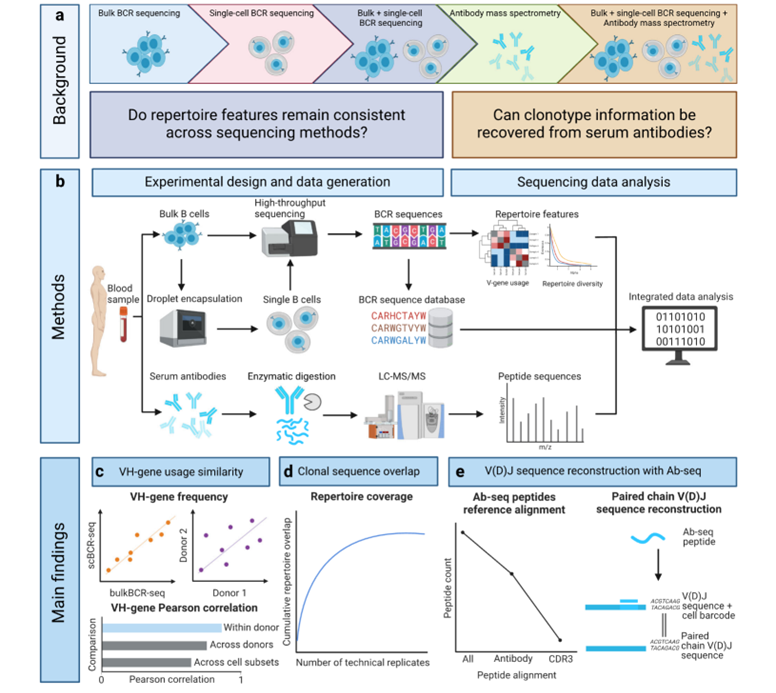
图1 基因组和蛋白质组水平分析抗体库
实验设计与数据集描述
研究人员从健康人外周血中分离B细胞,进行bulkBCR-seq和scBCR-seq,并结合公开测序数据分析,同时利用Ab-seq分析血清抗体。研究选用了三个数据集:数据集1对一位健康成人的B细胞进行测序和分析,探究采样深度和技术重复的影响;数据 2对十位健康成人的B细胞测序,分析跨个体情况;数据集3则利用已发表的患者数据,比较不同B细胞亚群的免疫库特征。研究重点关注VH基因使用频率、CDRH3序列重叠,以及从Ab-seq肽中识别克隆型和重建V(D)J序列等特征(图2)。
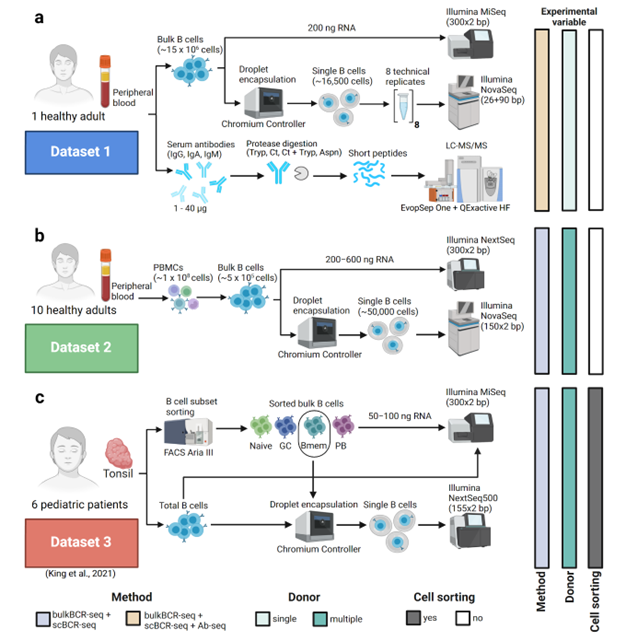
图 2研究使用的三个数据集描述
研究结果
1. BCR-seq揭示个体VH基因的情况高度一致
研究发现,无论是 bulkBCR-seq 还是 scBCR-seq,都能有效捕捉个体的VH基因使用特征。即使scBCR-seq采样深度较低,也能较好地反映个体的VH基因组成(图3)。
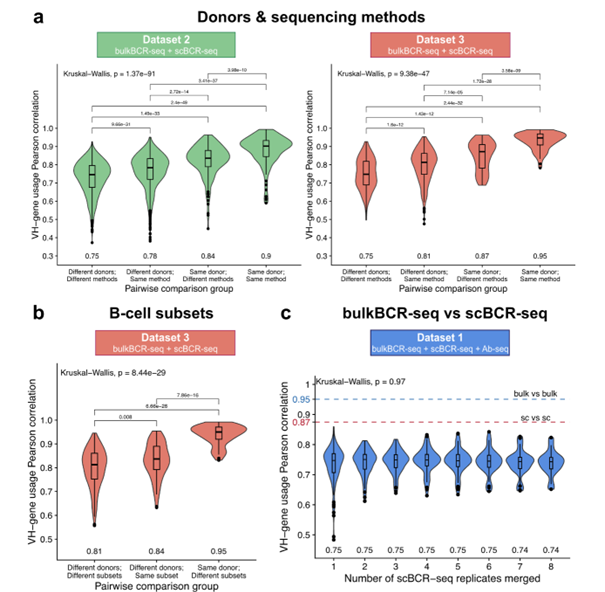
图 3 | bulkBCR-seq和scBCR-seq均可捕获个体的VH基因使用情况
2. bulkBCR-seq相较于scBCR-seq能更好地覆盖BCR库的生物学多样性
在免疫库多样性覆盖方面,bulkBCR-seq凭借更高的采样深度更具优势。相同同种型样本中,bulkBCR-seq与scBCR-seq的CDRH3序列重叠度更高。此外,研究还观察到“轻链一致性(LCC)”现象,即具有相似重链的B细胞往往也具有相似轻链,这在记忆B细胞中更为明显(图4)。
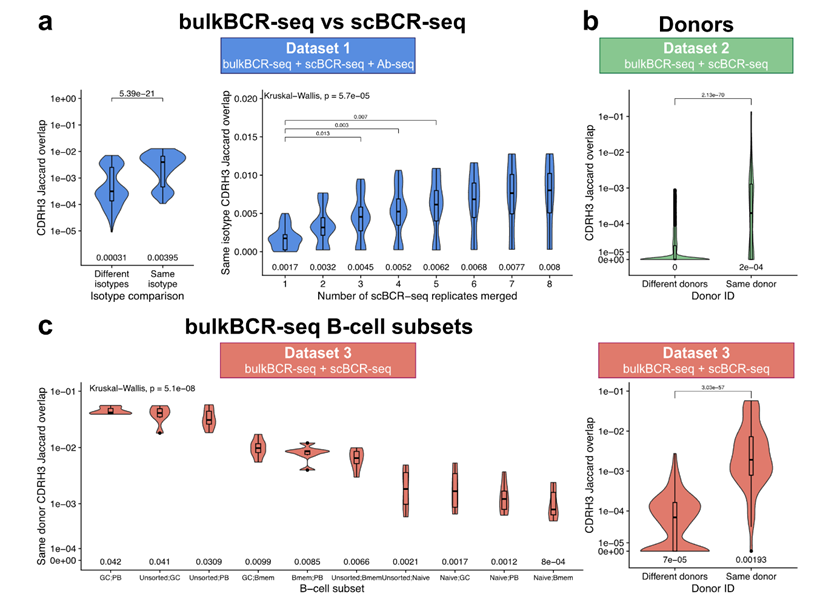
图 4 | bulkBCR-seq和scBCR-seq样本之间的CDRH3序列重叠情况
3. Ab-seq的应用:识别克隆型,重建V(D)J序列
Ab-seq是以个体的BCR-seq数据为参考,将血清中循环抗体酶切成肽段后,通过质谱分析中识别特定克隆型,并重建V (D) J序列。抗体的CDR3区域高度可变,决定了抗体对抗原的特异性识别。然而本研究中只有一小部分Ab-seq肽段能与CDR3重叠,且大多数匹配到的克隆型在BCR库中属于扩增程度较低的类型,揭示了BCR库与分泌型抗体库难以直接匹配的客观事实。
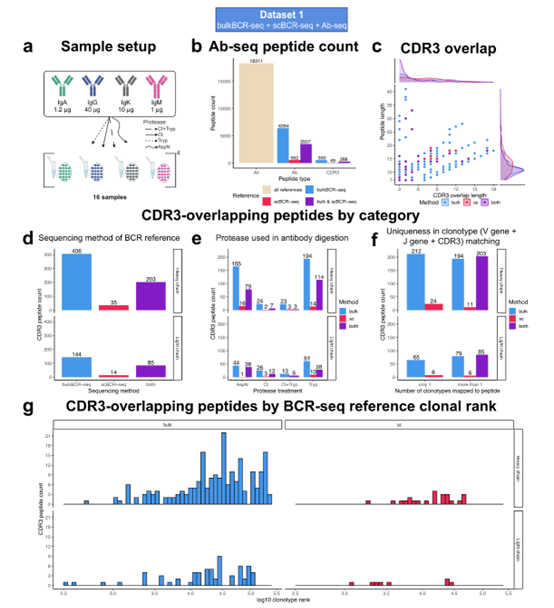
图 5 | Ab-seq肽与BCR-seq CDR3的匹配情况
总结
本研究聚焦于整合基因组和蛋白质组方法探究适应性免疫组库,长远来看,随着技术发展,scBCR-seq有望取代bulkBCR-seq成为检测BCR库的常规方法,但目前二者仍各有应用场景。尽管质谱法是目前最为成熟的蛋白质序列测定技术,但它在抗体测序方面的应用范围仍然较窄,未来随着机器学习、从头测序(de novo sequencing)等技术的发展和流程技术优化,期望实现的目标是能够在血清多克隆抗体的复杂背景下,直接从血液中精准鉴定出特定的抗体序列。
关注点:
(1) 全面解析BCR库与分泌性抗体库,是深入理解适应性免疫的前沿发展方向,而这一目标的实现高度依赖于相关技术的创新突破。
(2) 基于BCR-seq的方法虽然能高效获得B细胞基因数据,助力深入理解个体VH基因的使用情况,但无法对血清中循环的分泌性抗体进行有效检测。
(3) 外周B细胞中,仅有少部分能与循环抗体匹配,Ab-seq与BCR-seq的联合分析也佐证了这一点,仅通过BCR-seq可能遗漏珍贵的高丰度天然抗体。
(4) Rapid Novor 快序生物凭借全球唯一,基于质谱和从头测序的血清多抗测序技术,已实现直接解析天然血清多抗蛋白,获得能复现原始多抗性能的单抗序列。
参考文献:
[1] Lê Quý K, Chernigovskaya M, Stensland M, et al. Benchmarking and integrating human B-cell receptor genomic and antibody proteomic profiling. NPJ Syst Biol Appl. 2024;10(1):73. Published 2024 Jul 12.