
生物分子之间的相互作用是细胞过程和细胞结构的基石,异常的相互作用会导致细胞过程紊乱和失调,与疾病的发生密切相关。但目前常用的检测蛋白质相互作用(PPI)的方法,比如免疫沉淀法,需要把细胞裂解,这样就会丢失蛋白质相互作用的空间信息;而一些基于外源表达的方法,可能会给细胞原本的蛋白质相互作用网络带来未知的影响。目前仅邻近连接测定法(PLA)能原位检测内源性相互作用,但它的操作繁琐且成本高昂,应用受到限制。本文研究团队构建了一套全新的系统-纳米抗体辅助纳米荧光素酶(NanoLuc)片段互补技术(NanaPPI),它能实现原位测量和可视化内源性蛋白质-蛋白质相互作用,为我们研究PPI提供了全新的视角。
NanaPPI用于原位测量蛋白质-蛋白质相互作用的设计
纳米抗体来自骆驼科动物的重链抗体,它个头小、亲和力高,能特异性地识别目标蛋白;NanoLuc则可以在底物的作用下发出荧光,NanaPPI的设计巧妙地结合了两者的优势(图1 A)。具体来说,当细胞内的两个蛋白质发生相互作用时,针对这两个蛋白质的一抗就会它们分别结合到对应的蛋白质上。与此同时,与纳米抗体融合的NanoLuc 1.3kDa小片段(SF)和17.6kDa大片段(LgBiT)会被招募过来。这两个片段就像拼图的两块,在一抗的作用下靠近并重新组装成完整的有活性的NanoLuc。此时,加入特定的底物,NanoLuc就会发出荧光信号,我们就能通过检测荧光来知道蛋白质之间发生了相互作用,而且这个过程是在细胞原本的环境中进行的,很好地保留了蛋白质相互作用的空间信息。研究人员测试了不同的NanoLuc小片段,发现SF128和LgBiT组合在检测蛋白质相互作用时,信号与背景的比例最高,这个组合能让我们更清晰地捕捉到“蛋白质相互作用”。
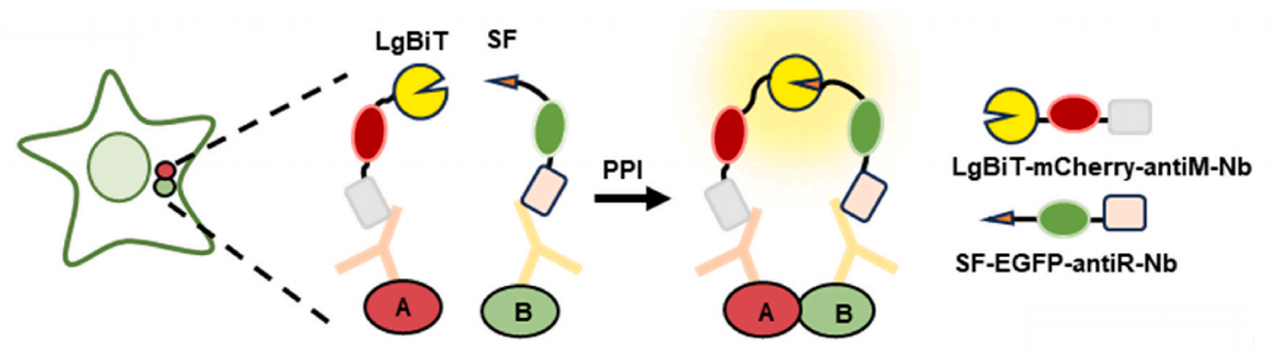
图1 NanaPPI的设计
NanaPPI 检测低丰度的蛋白质-蛋白质相互作用
接下来,研究人员用它检测了几对在细胞中含量相对较低的蛋白质相互作用,像富脯氨酸和谷氨酰胺的剪接因子(SFPQ)和无POU结构域八聚体核苷酸结合蛋白(NONO)、Yes关联蛋白1(YAP1)和TEA域转录因子4(TEAD4)、抑癌蛋白p53和双微体同源基因2(MDM2)。结果发现,NanaPPI都能给出很强的信号,检测效果非常好(图2)。
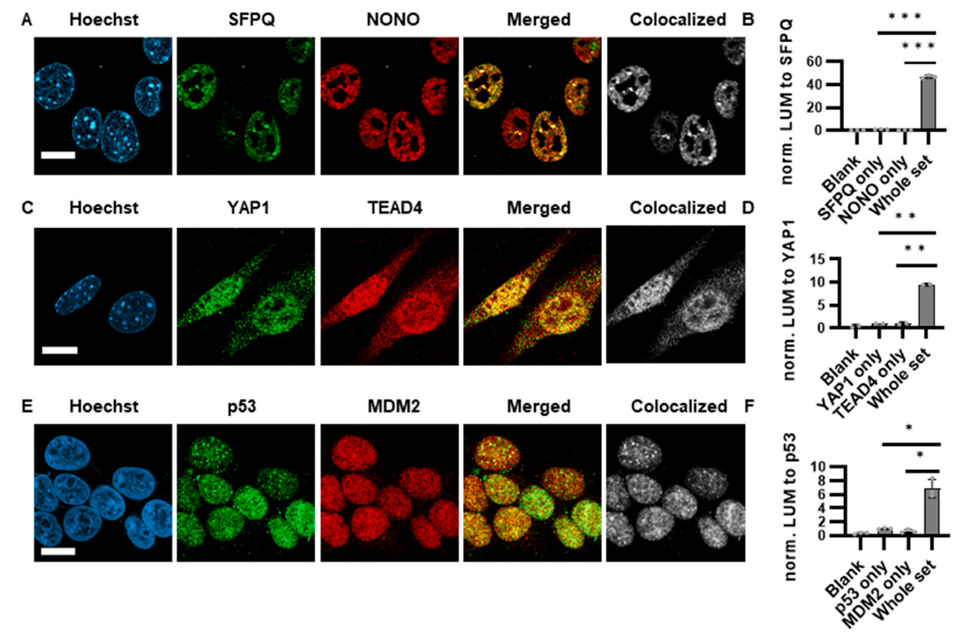
NanaPPI在固定细胞和组织切片中可视化蛋白质-蛋白质相互作用
不仅如此,NanaPPI还能直接把蛋白质相互作用的位置可视化(图3)。研究人员用发光显微镜,成功在固定的细胞和组织切片中看到了蛋白质相互作用发生的位置。比如,他们观察到α/β-微管蛋白的相互作用主要在细胞质(图3 A-B),p53和MDM2的相互作用在细胞核(图3 C-D)。通过重新分析癌症基因组图谱计划(TCGA)的数据,发现p53和MDM2在乳腺浸润性癌(BRCA)组织中的含量比正常乳腺组织中更高(图 3E - F),NanaPPI在组织切片成像中证实了这一结果(图 3G - H)。总体而言,这些结果验证了NanaPPI在固定的细胞和组织切片中可视化PPI事件空间位置的可行性和有效性。
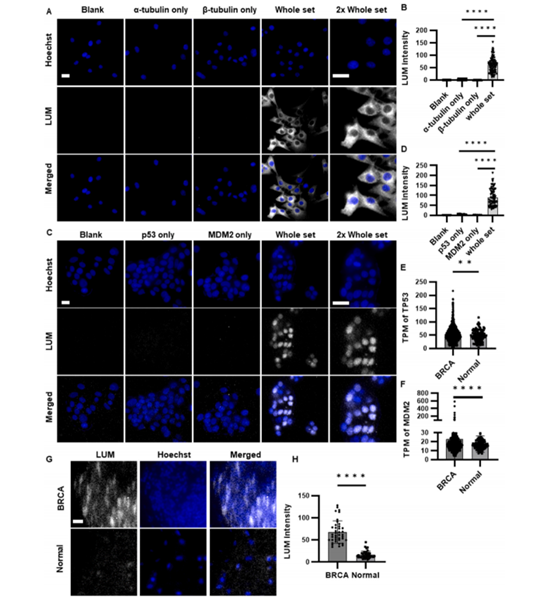
图3. 利用NanaPPI成像检测蛋白互作的位置
3.4 NanaPPI 检测蛋白质-蛋白质相互作用在不同刺激下的变化
NanaPPI还能用来研究不同刺激对蛋白质相互作用的影响。比如,用一种叫维替泊芬的小分子抑制剂处理细胞,它会抑制YAP1和TEAD4的相互作用(图4)。NanaPPI检测到,处理后的细胞中,YAP1和TEAD4的相互作用信号明显降低,和免疫染色的结果一致。另外,对比乳腺癌细胞MCF-7和正常细胞MCF-10A,NanaPPI发现MCF-7中α/β-微管蛋白的相互作用比MCF-10A弱,这对于研究癌细胞和正常细胞的差异很有帮助。
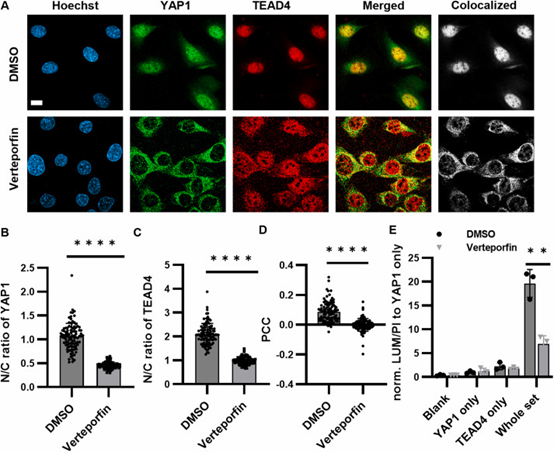
图 4. NanaPPI检测维替泊芬对YAP/TEAD4 PPI的抑制作用
NanaPPI 识别应激颗粒中的新蛋白质-蛋白质相互作用
更厉害的是,NanaPPI还发现了新的蛋白质相互作用。在应激颗粒中,它检测到了YTH N6-甲基腺苷RNA结合蛋白2(YTHDF2)和Ras-GTP酶激活蛋白SH3结构域结合蛋白1(G3BP1)、N6-腺苷酸甲基化(m6A)修饰和G3BP1的相互作用(图5)。而且,当细胞受到亚砷酸盐处理,处于应激状态时,这些相互作用会增强。进一步研究发现,YTHDF2在m⁶A修饰的mRNA富集到应激颗粒的过程中起着重要作用,为我们理解细胞在应激状态下的变化提供了新线索。
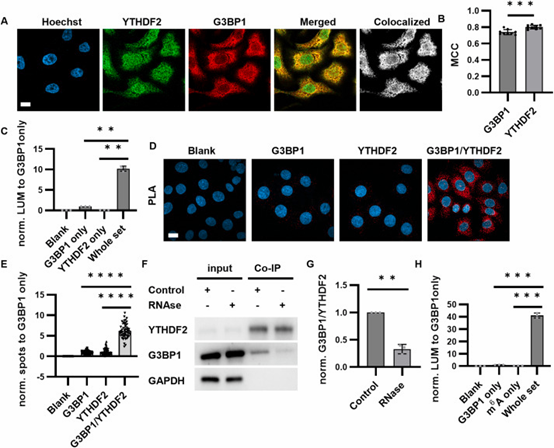
图 5.由NanaPPI揭示的YTHDF2与G3BP1之间的相互作用
和现有的检测方法相比,NanaPPI优势明显。它和PLA的信号背景比差不多,但操作更简便、检测速度更快、成本也更低。不过,NanaPPI也有一些不足之处。目前,它产生的发光信号只能在特定的显微镜下观察到;而且,和PLA一样,它的检测效果依赖高质量的一抗,如果一抗质量不好,可能会影响检测结果。
总的来说,NanaPPI为我们研究蛋白质相互作用提供了一个强大、便捷又经济的工具。它在发现新的蛋白质相互作用、筛选蛋白质相互作用抑制剂以及基于蛋白质相互作用的临床诊断等方面,都有着巨大的潜力。相信在未来,随着技术的不断完善,NanaPPI会帮助我们揭开更多生命科学的奥秘,为攻克疾病带来新的希望。
关注点:
(1) NanaPPI巧妙地结合了纳米抗体和NanoLuc的优势,实现PPI的原位检测,但其性能依赖高质量的一抗和优质的抗体开发技术。
(2) Rapid Novor 快序生物的REpAb多抗测序技术可以直接解析人或免疫动物的天然血清多抗蛋白序列,用于高性能纳米抗体和诊断/治疗用抗体的开发。
参考文献:
[1] Li Q, et al. Nanobody-assisted nanoluciferase fragment complementation for in situ measurement and visualization of endogenous protein-protein interaction. Biosens Bioelectron. 2025;272:117102.