摘要
L-甲状腺素(T4)的定量检测对于调节新陈代谢、疾病诊断以及监测T4替代疗法的疗效至关重要。然而T4是低分子量(777g/mol)的半抗原生物标志物,传统的免疫分析方法较难检测这类小分子。本文中研究团队通过大肠杆菌重组表达T4抗体的单链可变片段(scFv),并对其进行荧光标记,构建了基于Quenchbody的一步式免疫分析方法。这种方法将T4的检测时间降低至3分钟,适用于T4的快速检测。

主要结果
重组表达抗T4 ScFv建立间接法ELISA检测方法
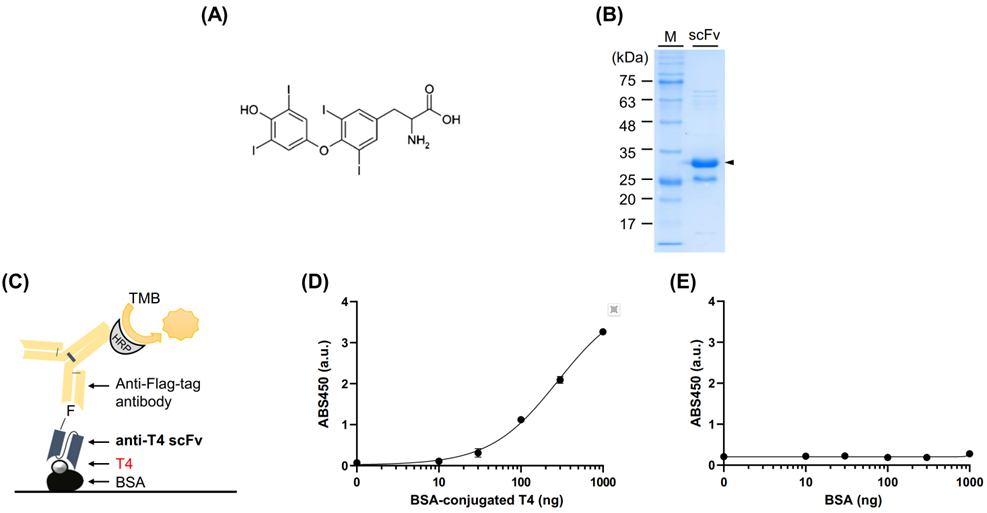
首先,研究团队在大肠杆菌进行重组表达,获得了抗T4抗体的 ScFv(图1 B)。T4作为不带正电荷的小分子半抗原(图1 A),难以直接固定在聚苯乙烯材质的ELISA板上。因此为解决这个问题,研究团队将T4与作为载体蛋白的牛血清白蛋白(BSA)偶联,成功将T4固定在ELISA板上,并对ScFv的抗原结合能力进行了评估(图1 C)。结果显示,ScFv有较好的T4结合能力,检测限(LOD)为6.4 ng/100μl(图1 D),同时不结合BSA(图1 E)。此外,T4 ScFv也不结合BSA载体上的其他分子量接近的小分子半抗原,表明其对T4有较好的特异性结合能力。
使用抗T4 ScFv建立夹心法ELISA检测方法
由于间接法只能检测BSA载体上的T4,不适用于实际的诊断系统。而夹心法需要两个分别结合到抗原两个独特表位的抗体,而小分子很难具备这种条件,需要进行精心优化方法。团队建立了夹心法ELISA,将抗T4 ScFv固定在板上捕获T4,使用小鼠抗T4抗体作为检测抗体,辣根过氧化物酶(HRP)标记的抗小鼠 IgG 抗体作为二抗(图2 A)。平均半数有效浓度(EC50)和检测限(LOD)分别为 324和 9.6ng/100μl(图 2D)。而反过来将T4抗体作为捕获抗体,ScFv作为检测抗体,采用HRP 标记的抗Flag 标签抗体作为二抗时(图2 B),EC50 和 LOD 分别为 114 和 1.1ng/100μl(图2 E)。成年人甲状腺功能减退和亢进时,T4水平分别为低于45μg/L和高于112μg/L,均在该方法的检测范围内。
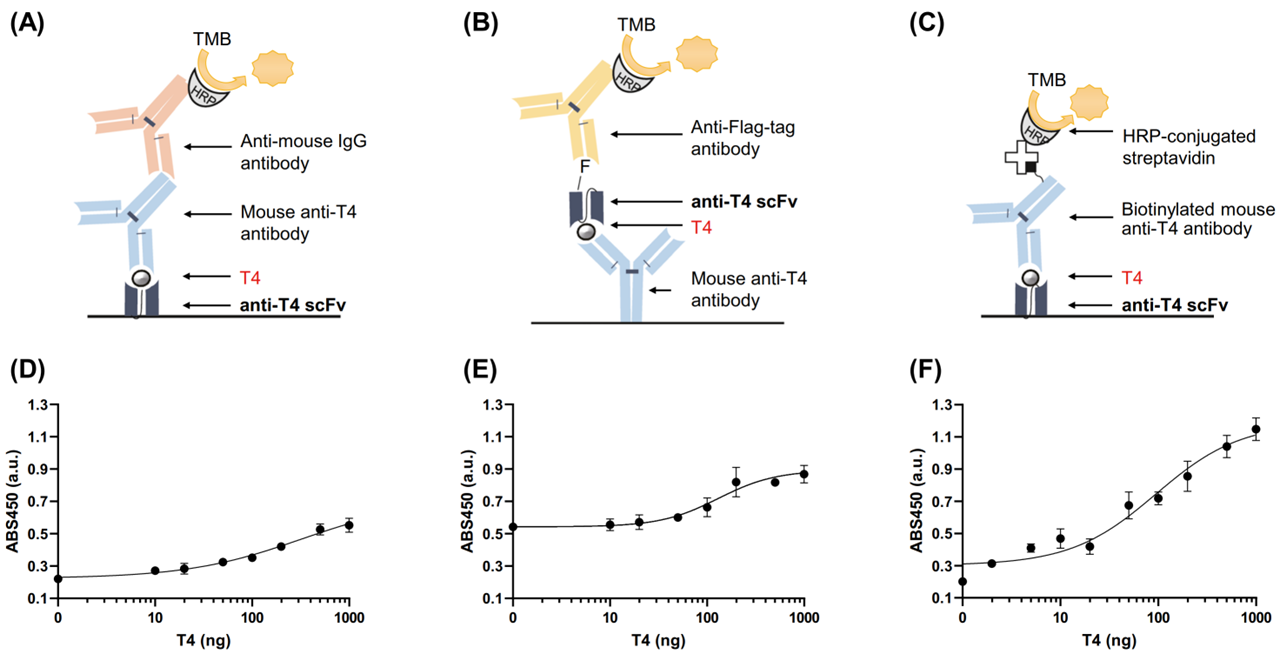
图2 基于T4 ScFv构建的夹心法ELISA方法
抗T4 Quenchbody的制备和检测方法开发
Quenchbody是一种结合了荧光染料的抗体或抗体片段,通常在ScFv或Fab N末端进行荧光染料标记。由于染料的疏水性,其会进入抗体可变区,通过与色氨酸(Trp)残基的光诱导电子转移作用导致荧光淬灭。当Quenchbody与抗原结合,这种稳定作用和形成的空间位阻使染料移动到抗体外部,从而恢复荧光(图3)。整个检测只需一步反应,可在几分钟内完成。
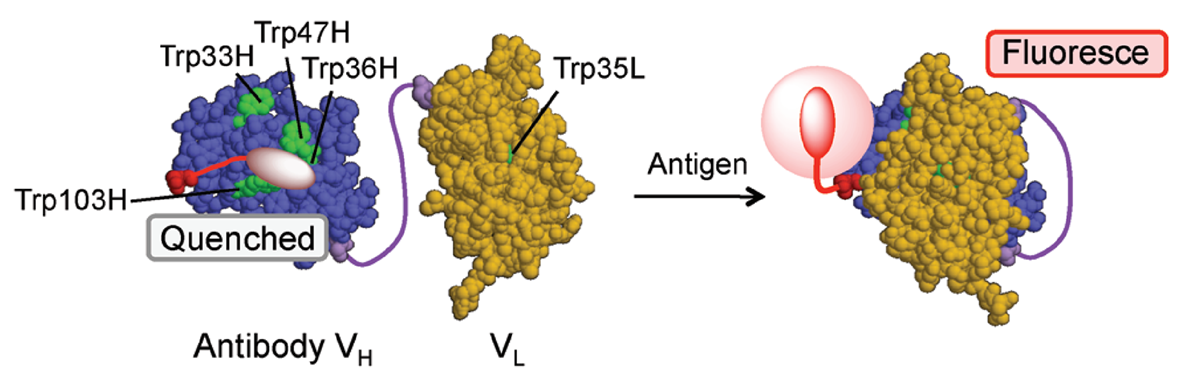
图3 Quenchbody作用机制示意图[2]
本文中,研究团队便通过类似策略构建了抗T4 ScFv的Quenchbody(图4 A-B)。重组表达时,在ScFv N末端加入了Cys标签用于荧光标记,将罗丹明染料TAMRA-C5-maleimide通过马来酰亚胺-硫醇反应与Cys标签连接。在加入变性剂后,荧光强度增加(图4 C),而加入不同浓度T4时,荧光呈剂量依赖性下降(图4 D E),LOD为408ng/ml,可用于诊断甲状腺功能亢进。这种荧光强度随抗原浓度降低的现象,提示抗原存在时,染料可能靠近Trp残基,进而增强淬灭效果。在50%血清中添加不同浓度T4的模拟临床样本中,得到了与上述相符的结果,表明该方法有望用于患者血清样本中T4浓度检测(图4 F)。
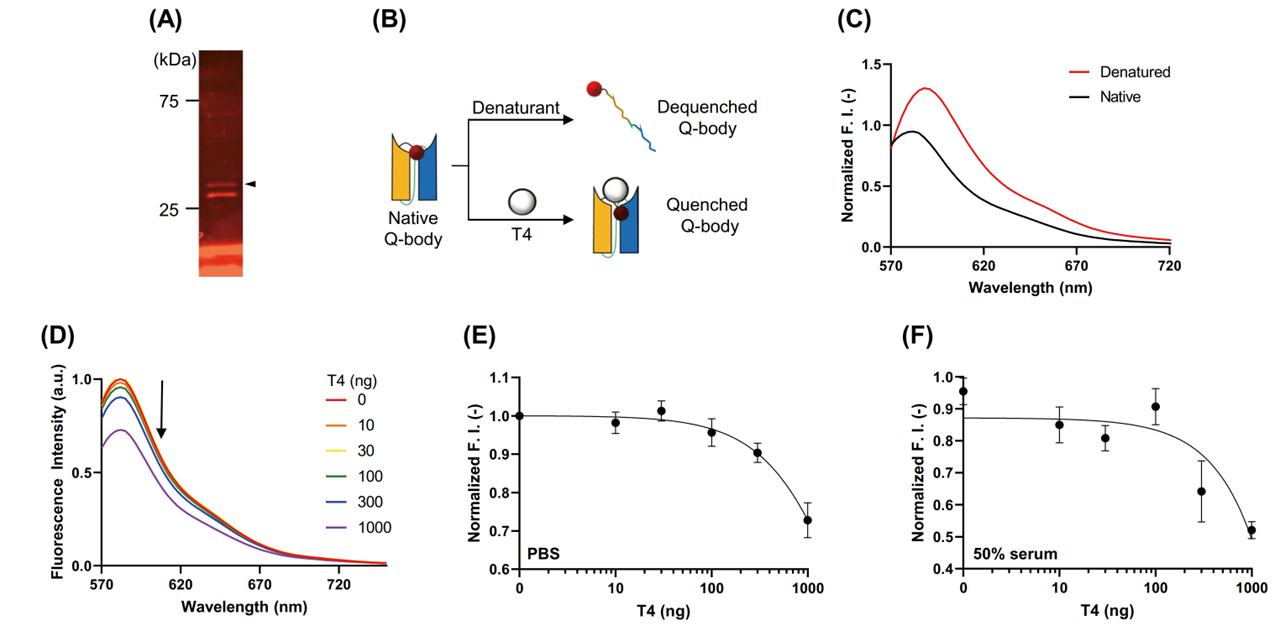
图4 抗T4 ScFv Quenchbody检测方法的建立和评估
关注点:
[1]本文建立了ELISA和Quenchbody两种方法用于T4检测,前者灵敏度高,后者检测速度快、成本低,因此这两种方法可以适应不同场景下的检测需求。Quenchbody快速检测的优势也可应用于其他小分子的检测,例如激素、农药兽药重金属残留、抗生素、食品添加剂等等。
[2]建立夹心法ELISA需要两个配对抗体识别两个独特表位,而小分子往往只有一个抗原决定簇,且表面积小,给夹心法的开发造成困难。Quenchbody在小分子检测领域有较好应用前景。
[3]小分子抗体的开发对抗体发现技术提出了更高要求,Rapid Novor快序生物可提供全球唯一基于血清多抗蛋白测序的抗体发现服务,对筛选评测满意的多抗直接测序,获得天然抗体序列,复现原始多抗性能,快速锁定优质抗体,确保研发可控。
参考文献:
[1]Yun HY, Yun H, Jeong HJ. Establishment of a Quenchbody-based L-thyroxine detection method and its comparison with ELISA systems. Anal Bioanal Chem. 2024 Nov;416(28):6171-6180. doi: 10.1007/s00216-024-05558-5.
[2]Abe R, Ohashi H, Iijima I, Ihara M, Takagi H, Hohsaka T, Ueda H. "Quenchbodies": quench-based antibody probes that show antigen-dependent fluorescence. J Am Chem Soc. 2011 Nov 2;133(43):17386-94. doi: 10.1021/ja205925j.
[3]Dong J, Ueda H. Recent Advances in Quenchbody, a Fluorescent Immunosensor. Sensors (Basel). 2021 Feb 9;21(4):1223. doi: 10.3390/s21041223.