
多发性骨髓瘤(MM)是一种恶性浆细胞疾病,核心特征是异常浆细胞大量分泌序列一致的单克隆蛋白(M 蛋白)。M蛋白的变化是判断病情缓解与复发的关键指标。随着治疗技术进步,患者对标志物精准监测需求迫切:传统血清蛋白电泳(SPEP)、免疫固定泳(IFX)灵敏度有限,难以捕捉微量M蛋白和残留病灶;骨髓活检(NGF/NGS)虽灵敏但侵入性强,无法频繁动态监测。如今,质谱(MS)技术凭借超高灵敏度和非侵入性优势快速崛起,正改变MM临床监测格局,且已从科研转向商业化应用。
一、为什么临床需要更优的MRD监测手段?
在多发性骨髓瘤领域,微小残留病灶(MRD)是判断预后的核心指标,MRD阴性的患者,往往生存期更长、复发风险更低。2024年,美国FDA肿瘤药物咨询委员会全票支持通过了一项议题,使用MRD作为加速MM新药研究的替代终点。然而,传统的MRD监测技术,存在明显局限:
骨髓MRD检测:精准但有缺陷
骨髓穿刺是目前MRD评估的成熟方案,通过下一代测序(NGS)或下一代流式细胞术(NGF),能检测到10⁻⁵~10⁻⁶水平的残留细胞,虽灵敏度高,但它的缺点也很明显:
有创操作:需要骨髓穿刺采样,患者依从性差,无法频繁检测;
假阴性风险:多发性骨髓瘤可能存在“骨髓病灶分布不均”导致假阴性;
无法覆盖髓外病灶:对于骨髓外的残留癌细胞,骨髓检测无能为力。
传统血液 MRD 检测:便捷但灵敏度不足
研究人员将NGF、NGS等技术应用于外周血,这些“液体活检”虽无创,但外周血肿瘤标志物浓度低,灵敏度未超骨髓检测。临床上,SPEP、IFX一直被用于常规检测M蛋白,但灵敏度低(SPEP 0.1g/dL,IFX 0.01g/dL),难以捕捉深度缓解后的微量M蛋白;正是这种“困境”,推动了质谱技术的临床转化——它既保留了外周血检测的“无创便捷”,又实现了与骨髓检测相当甚至更优的“超高灵敏度”,且已从科研应用转向商业化,满足临床对MM外周MRD动态监测的需求。
二、质谱如何“精准捕捉”M蛋白?
质谱技术利用M蛋白独特的分子特征(分子量、氨基酸序列),从正常多抗蛋白背景中精准识别并定量M蛋白,临床应用主要分两大技术路线(图1):
自上而下法(完整轻链法)
自上而下法是直接分析完整免疫球蛋白轻链的质荷比(m/z),通过其与正常背景多抗的差异实现检测。该方法周转速度快,适合临床高通量筛查。但在低疾病负荷状态下受多克隆背景干扰,采集基线样本可提升低丰度M蛋白检测灵敏度。常用平台包括基质辅助激光解吸电离-飞行时间(MALDI-TOF)和液相色谱-质谱(LC-MS)。代表技术有已实现商业化的由Mayo Clinic开发的MASS-FIX,和Thermo Fisher开发的EXENT平台,灵敏度超传统SPEP十至数十倍。
自下而上法(克隆特征肽法)
自下而上法出现时间晚于自上而下法,灵敏度更高但流程复杂、周转时间长。该方法先将M蛋白酶解为肽段,通过质谱从头测序确定患者独特克隆特征肽序列,再通过靶向质谱技术监测该序列,具有极高的灵敏度(比自上而下策略高10-100倍,比传统SPEP高1000倍),是目前检测下限最低的技术,因此有望取代骨髓检测。该方法需收集诊断时或治疗早期的基线样本,代表技术为Rapid Novor快序生物的EasyM和Sebia的M-Insight平台,均已在美国商业化。
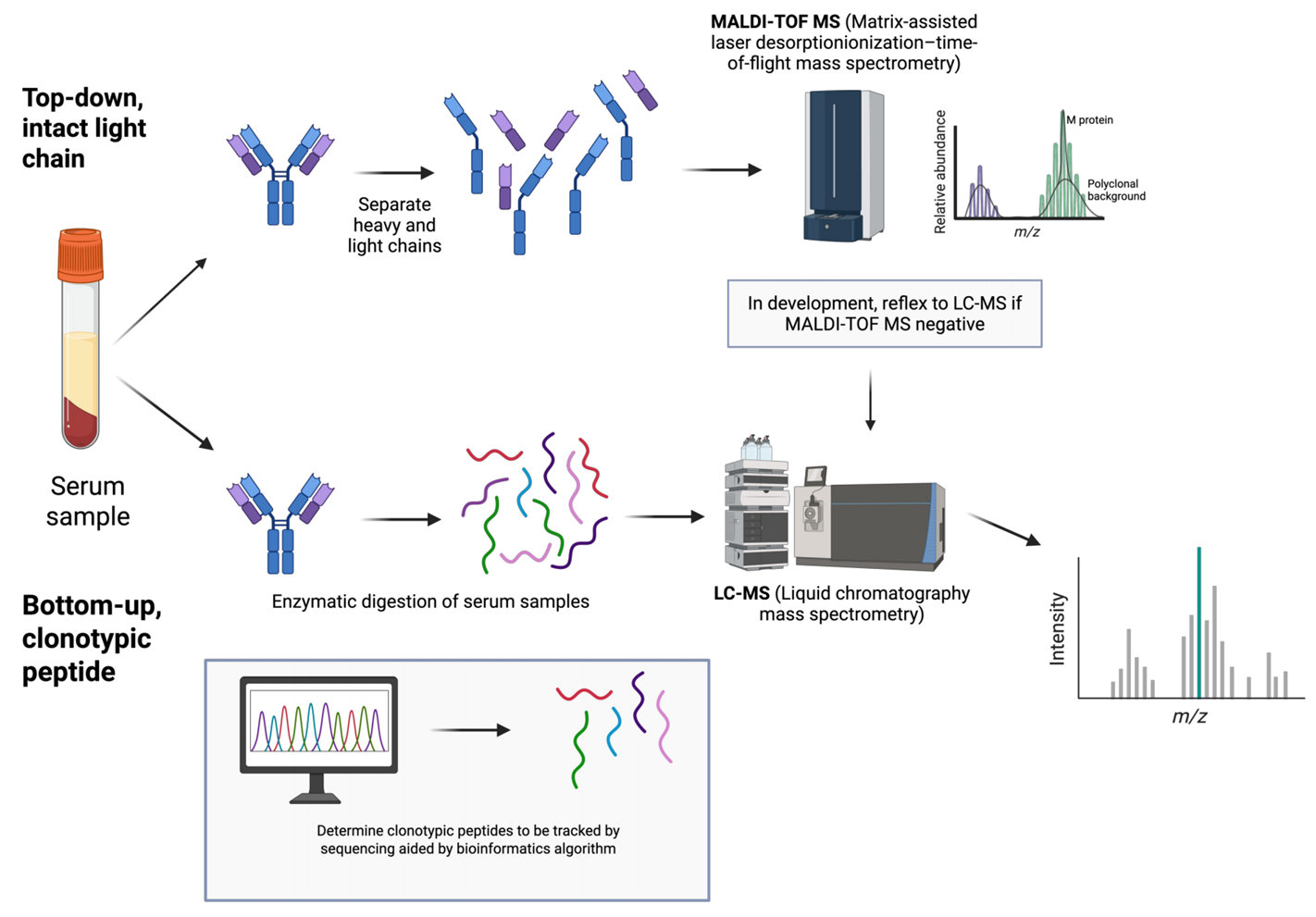
图1 质谱检测M蛋白的两大路径
三、质谱在多发性骨髓瘤中的临床应用价值
大量临床试验数据证实,质谱技术是能直接指导治疗决策、改善患者预后的强大工具。传统的“CR”(血液/尿液中检测不到M蛋白)并不能完全代表“病情控制好”——部分CR患者仍会复发。而质谱检测的M蛋白残留状态,能更精准预测生存期:
自上而下(完整轻链法):已有充分证据表明,在许多SPEP/IFX无法检测到M蛋白的病例中,MALDI-MS仍可检出,这使得质谱的预后评估价值更优。例如在STaMINA试验中,MASS-FIX阴性患者的无进展生存期(PFS)与总生存期(OS)显著优于SPEP/IFX阴性或完全缓解(CR)患者;西班牙一项研究显示,EXENT对PFS的预测准确性远超SPEP/IFX,且在治疗后期的预后意义更显著;
而与传统骨髓鉴定方法对比,在一项研究中MALDI-MS与NGS 的一致性为83%,而LC-MS与NGS的一致性仅为63%。这种低一致性可能反映了LC-MS具有更高的灵敏度,能检测NGS未检出的残留病灶。另外一些研究表明,基于自上而下MALDI技术的质谱检测灵敏度低于骨髓NGF,可能不足以作为独立的MRD替代研究方法。而将该方法与NGF/NGS检测结果相结合,可提升预后评估效能。
自下而上(克隆特征肽法):基于克隆特征肽的质谱方法,检测M蛋白的能力优于自上而下法,甚至能堪比骨髓NGS/NGF MRD检测的公认标准。加拿大一项新发MM试验中,EasyM能检出89% CR患者的残留M蛋白,在中国的一项针对新诊断患者的回顾性研究中,对于骨髓NGF检测(灵敏度10⁻⁵)为阴性的患者,EasyM的检出率仍达81.8%;在澳大利亚两项EasyM研究中,74%达到CR且骨髓NGF阴性的新诊断患者,其EasyM检测仍为阳性。类似策略的M-Insight也表现出了极佳的检测能力。
质谱兼具高灵敏度和高检测频率的优势,能够在SPEP/IFX检测到异常前,为疾病进展提供早期预警,且无需骨髓活检。而质谱MRD复阳,有望作为调整治疗的信号,以及患者预后不良的关键指征。更进一步,质谱联合骨髓NGS/NGF检测,有望在MM的疾病治愈定义中发挥作用。
除此以外,质谱技术还可以指导骨髓MRD检测的精准应用,降低医疗成本。一些治疗中常用的单克隆IgGκ型抗体,会干扰传统IFX检测,可能让医生误将药物信号当作M蛋白残留,而质谱技术可以对它们进行精准区分。另外对于一些非分泌型的MM患者,即传统方法检测不到M蛋白,无法监测病情变化,可以通过灵敏度更高的质谱技术打破这一困境。
四、质谱应用的局限性与注意事项
尽管优势显著,质谱技术目前仍有需要突破的瓶颈,临床应用时需理性看待:
单克隆蛋白清除延迟
质谱用于MRD评估的一个局限性是M蛋白的半衰期较长,IgG约为23天,IgA约为4-7天,游离轻链仅数小时,此外,IgG单克隆蛋白浓度越低,其清除速度越慢。这导致即使骨髓病灶已清除,外周血中残留的M蛋白仍可能被质谱检测到,这一现象也可能解释为何质谱的预后价值会随时间推移而提升。未来需明确IgG型、IgA型和轻链型多发性骨髓瘤患者达到质谱阴性的时间差异,以正确解读质谱结果;此外,单克隆蛋白浓度阈值与浓度降低百分比对预后的影响,也需在未来研究中进一步明确。
需基线样本
尽管克隆特征肽法的灵敏度最高,但该方法需采集就诊早期,或治疗开始前的基线样本,以获得特征克隆肽信息。自上而下的MALDI-MS虽不依赖基线样本,但其灵敏度略逊一筹,且该方法易受多克隆背景抗体的干扰,如果能获得基线样本,其检测灵敏度也能得到提升。
五、总结
哪种质谱(MS)检测方法最优?答案取决于具体应用场景:若能获取基线样本,克隆特征肽法灵敏度最高,可达到或超过骨髓MRD检测方法;MALDI-MS和LC-MS的性能介于传统SPEP/IFX与克隆型肽法之间,但不依赖基线样本。尽管质谱法作为最灵敏的外周血M蛋白检测技术有诸多独到优势,但将外周血检测、骨髓检测和影像学检查相结合,才能获得最具临床意义的疾病评估结果。未来需通过持续研究,充分发挥质谱的应用潜力,明确其与其他MRD检测方法的成本差异,并进一步将其整合到多发性骨髓瘤的临床诊疗中。
参考文献
[1]Derman BA, Yee AJ. Clinical applications of mass spectrometry in multiple myeloma. Blood Adv. Published online September 8, 2025.