
文章重点
1. IgM聚体的组装必须先形成一种“非天然二硫键”,进而再形成正确组装形式;
2.ERp44是调节IgM组装的关键分子,调节其功能可直接影响IgM表达;
3.IgM重链C末端的尾链,对其正确聚合具有关键作用,通过抗体测序获得其包括C端的全长序列对其正确组装表达十分必要。
提到抗体,大家可能首先想到的是IgG,它在抗体药物、诊断科研工具等领域都有广泛的应用。不过在对抗感染的早期,IgM是当之无愧的“先遣部队”,它是人体接触病原体后最早产生的抗体,堪称体液免疫的第一道防线。另外分泌型的IgM是以五聚体或六聚体形式组成:当存在J链时,会形成由5个μ₂L₂亚基构成的五聚体,参与黏膜免疫;若J链缺失,则6个μ₂L₂亚基会组装为六聚体,激活补体依赖的细胞毒性效率更强。IgM聚体这种多价结合的特征,使其对早期感染有强大的快速反应能力。
然而,IgM抗体的复杂组成,也为其体外重组表达带来了一定困难。除了轻重链氨基酸序列正确以外,形成正确的糖基化形式、聚体组成形式、二硫键链接方式等都需要精确的控制。因此表达困难的表象背后,需要的是我们对其表达组装机理有更进一步的认识。
2022年在《The EMBO Journal》上发表的一项研究,便揭示了分泌型IgM组装的奥秘——两个单体(μ₂L₂)之间在组装之前,先会形成一种传统认为是错配的“亚基内二硫键”,进而由一种蛋白质二硫键异构酶ERp44调节形成组装正确的五聚体或六聚体。这一发现拓展了对IgM聚体组装机制的理解,也为抗体工程和疾病研究提供了新的思路。
1. IgM:两种形态,两种“使命”
IgM作为最先产生的抗体类型,有两种形态:一种是作为B细胞表面受体(BCR)的膜结合型(μm),负责“侦察”病原体信号;另一种是分泌型(μs),当B细胞被病原体激活后,就会大量生产这种IgM,释放到血液或黏膜中“作战”。分泌型IgM会形成由五个或六个单体μ₂L₂亚基(2条重链μ和2条轻链L组合)组成的聚体,这种庞大的体型也赋予了IgM在感染初期的强大战斗力。而有趣的是,膜蛋白型IgM并不会形成聚体,这就留下了一个谜题,也是本文解决的核心问题——细胞在表达时是如何区分这两种IgM,让分泌型形成正确的聚体,而不会把膜蛋白型聚合在一起?
2. “错误连接”的二硫键,竟是IgM聚体形成的关键
研究团队通过实验观察到:在分泌型IgM的组装过程中,μ₂L₂亚基里的两个C575(575位半胱氨酸)会先形成一种“亚基内二硫键”—— 简单说,就是同一个“小单元”的两个C575连在了一起。从传统视角看,这是典型的“错误连接”:因为最终形成聚合物时,C575需要和另一个亚基的C575连接,而不是自己“左手绑右手”。
更让人意外的是,这种“错配二硫键”形成的中间体数量,竟然和IgM的聚合效率正相关:当B细胞受到LPS(一种细菌成分)激活、开始大量分泌IgM时,这种中间体急速增多,而一旦没有这种结构,IgM就很难形成聚合物,只能以单个亚基的形式被分泌出去。
进一步的研究中,团队把C575突变成了不能形成二硫键的丙氨酸(C575A),结果发现只能分泌IgM单体。另外突变尾区的疏水氨基酸L566(L566A),虽然还能形成这种C575的非天然连接,但这些中间体无法一步组装,还是以单体分泌。这些现象表明,C575发生的非天然连接,并不是组装错误,而是分泌型IgM形成的必要过渡步骤。
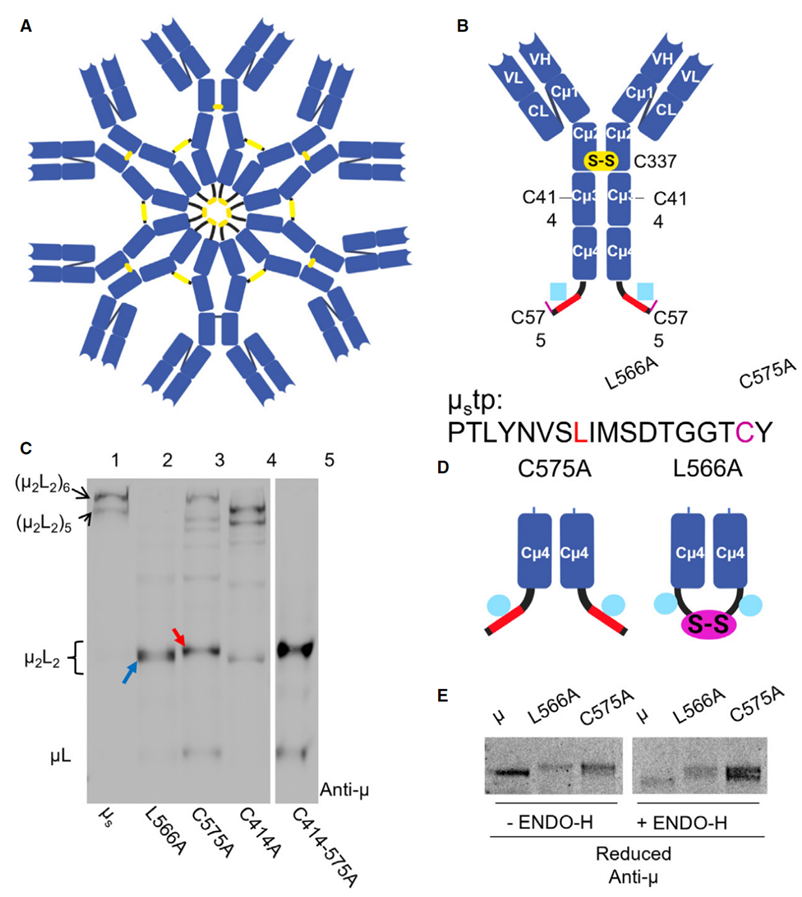
重链C端关键位点的突变会导致IgM聚体无法正确组装
3.ERp44:组装IgM聚体的“分子工匠”
既然这种二硫键是IgM聚体组装所必须的,同时又是连接错误的,那就表明细胞内一定有一种机制可以把它拆开,再重新连接正确。研究结果表明,这个关键的“分子工匠”是蛋白质二硫键异构酶ERp44。
ERp44主要在ER(内质网)和高尔基体之间工作,负责修正蛋白质的错误二硫键。其作用于 IgM 的过程可分为三步:
(1)识别并攻击非天然键:ERp44 通过其活性位点的半胱氨酸(C29)进攻中间体的非天然二硫键,打断亚基内错误连接;
(2)诱导构象变化与聚合:这种相互作用促使μ₂L₂亚基构象改变,暴露原本遮蔽的C414位点,使其与其他亚基的C414形成天然亚基间二硫键,推动聚体组装;
(3)循环再利用:当正确的五聚体/六聚体形成后,ERp44释放IgM,自身恢复还原态,继续处理下一个中间体。
为了证明ERp44的重要性,研究团队构建了ERp44基因敲除(ERp44KO)的细胞。结果显示,这些细胞几乎无法分泌完整的IgM聚合物,只能释放大量带有“非天然键”的单个亚基;而当重新导入野生型Halo-ERp44后,细胞又能恢复IgM的正常组装和分泌。若导入无活性的ERp44突变体,则无法促进聚合。
更有意思的是,ERp44还能“区分”两种IgM:它只作用于分泌型IgM的“非天然键”,而膜结合型IgM的重链C末端没有分泌型IgM重链的尾段,不会形成C575的非天然二硫键,因此不受Erp44影响。这就解释了为什么膜结合型IgM不会形成聚合物——因为它的C414不会被激活,也不会被ERp44“引导”组装。
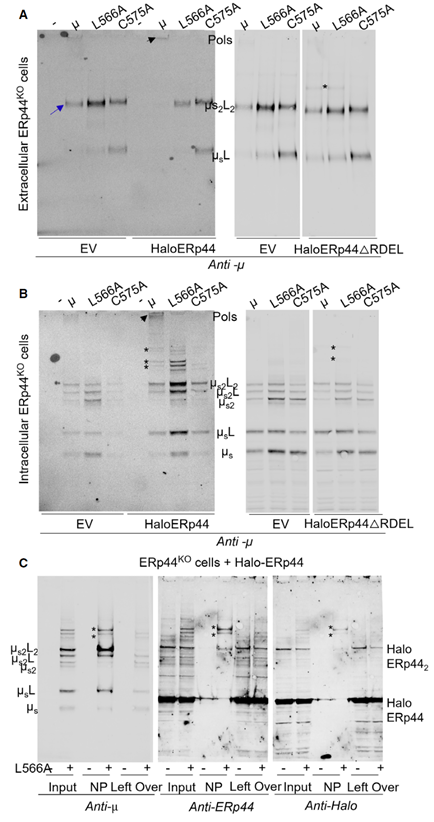
ERp44攻击单个亚基内两个C575形成的非天然二硫键
4. 进化的智慧:为什么要绕“非天然键”这个弯?
看到这里,你可能会问:既然最终要形成“天然键”,为什么细胞要先形成“非天然键”,多此一举呢?这个看似复杂的机制,背后藏着进化的精妙设计:
(1)保护膜型IgM的功能:膜型IgM是B细胞的“传感器”,如果它也形成聚合物,就会破坏BCR的结构和信号传递能力。而这种“非天然键 + ERp44修复”的机制仅针对含μₛtp的分泌型IgM,膜型IgM因C末端结构差异豁免,确保B细胞能正常识别抗原并激活。
(2)严格的质量控制:“非天然二硫键键”相当于一个“检验标签”:只有能形成这种中间体的μ₂L₂亚基,才会被ERp44识别并引导组装;如果亚基本身折叠错误(如无法形成C575非天然键),就会被细胞当作“不合格产品”降解,避免分泌出功能异常的IgM。
(3)提高组装效率与稳定性:“非天然键”能让单个μ₂L₂亚基保持紧凑构象,避免它们在组装前被细胞内的其他分子破坏;同时,ERp44的“催化”作用能加速亚基间的连接,让IgM能快速组装并分泌,及时应对病原体感染——这对免疫系统的“快速反应”至关重要。
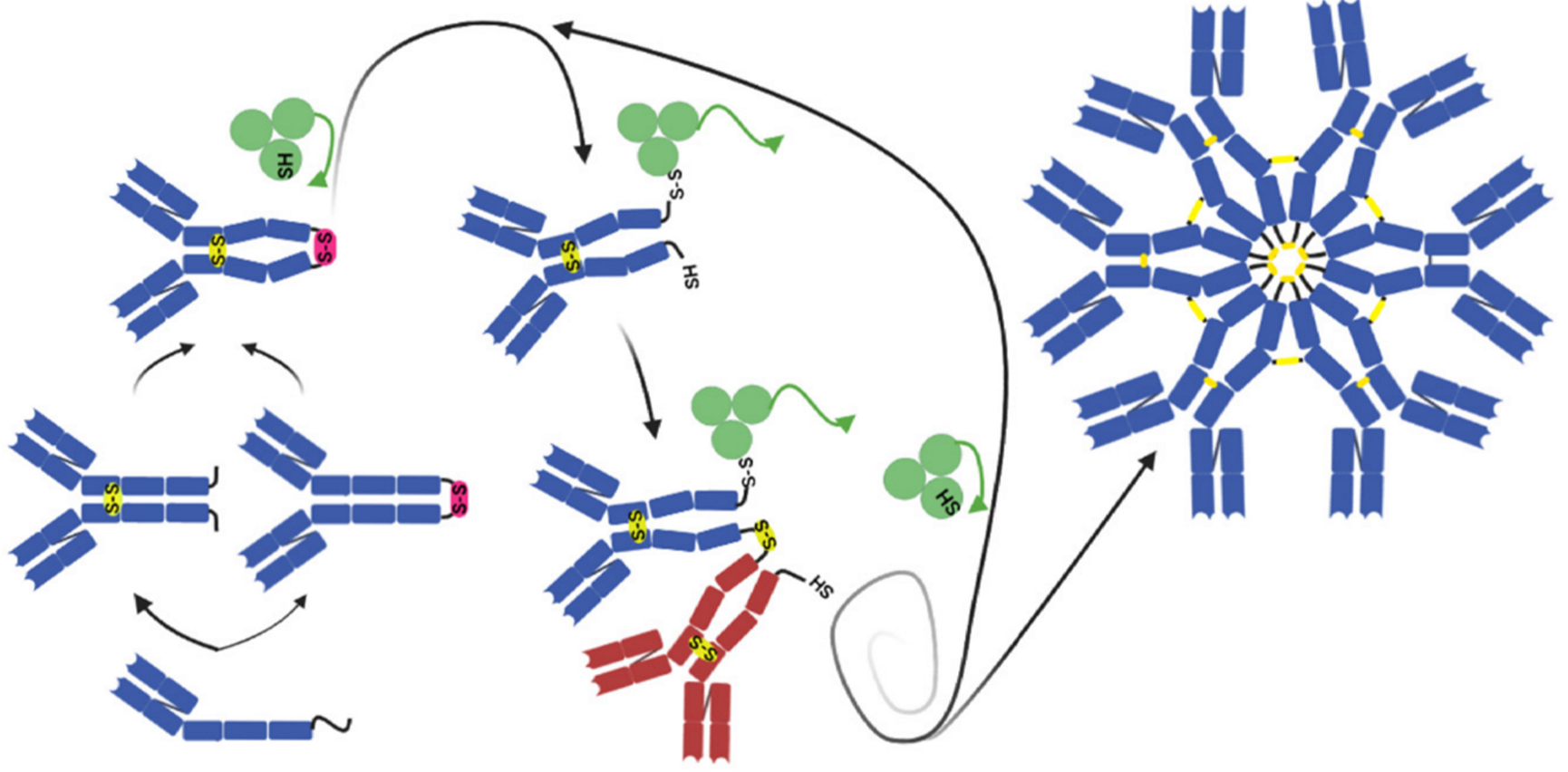
IgM六聚体的组装机制示意图
5. 从基础研究到应用:为IgM抗体开发破局
这项研究不仅解开了IgM组装的谜题,还为抗体工程和疾病研究提供了新的思路。在抗体药物和科研诊断工具开发中,IgM因其“多价结合”的特性,在对抗病毒、细菌感染和肿瘤方面有独特优势。但分泌型IgM的体外表达难度相对较大,一定程度上也是由于对其组装机制理解的不够深入。这项研究明确了“非天然键+ERp44”的核心作用,我们就可以通过调控ERp44的活性,或者优化μ链的尾区结构,来提高重组IgM的表达效率,为开发更高效的IgM抗体药物和试剂奠定基础。
参考文献
[1] Giannone C, Chelazzi MR, Orsi A, et al. Biogenesis of secretory immunoglobulin M requires intermediate non-native disulfide bonds and engagement of the protein disulfide isomerase ERp44. EMBO J. 2022;41(3):e108518.